
创建自己的小题库
搜索

化学反应方程式题库
题数
833
考试分类
高中化学>化学反应方程式
售价
¥25
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-化学反应方程式
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【简答题】

[1/833]洋蓟素是一种新型的抗乙型肝炎和艾滋病病毒的化合物,其结构如图所示.请回答下列问题: 【图片】(1)洋蓟素分子中“苯环上的含氧官能团”的名称是_____...
参考答案:
| (1)根据有机物的结构简式可知洋蓟素分子中“苯环上的含氧官能团”的名称是羟基,含有酚羟基的物质具有弱酸性,故答案为:羟基;酸; (2)A、芳香烃是含有苯环的烃,该有机物中含有氧元素,不是挺烃类,故A错误; B、该有机物中含有碳碳双键,可以使酸性KMnO4和溴水褪色,故B正确; C、该有机物中含有酚羟基,能与氯化铁溶液发生显色反应,故B正确; D、该有机物中含有酚羟基能发生卤代反应,含有醇羟基和羧基,能发生酯化反应,含有苯环可以发生硝化和磺化反应,故C正确; E、1mol该有机物中含有4mol酚羟基,可与4molNaOH反应,含有1mool羧基和2mol酯基,可以和3mol氢氧化钠反应,共消耗氢氧化钠7mol,故E错误; F、该有机物中不含醛基,不能与新制Cu(OH)2发生变红色的反应,故F正确. 故选AE; (3)①该有机物中含有酯基,可以水解,水解时,酯基中的碳氧单键断开生成羧基和羟基即可,其中苯环可以被双键加成成环己烷结构,碳碳双键被加成为烷烃结构,根据化学方程式: 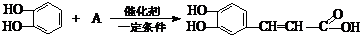 ,根据加成反应的特点,可以推得A物质的结构简式为  ,故答案为: 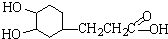 (  或  ); ②R是有机物水解产物中不含有苯环的部分,分子式为C7H12O6,与浓硫酸共热,当只消去环上羧基的间位的2个官能团,并生成对称双键产物的化学反应方程式为: 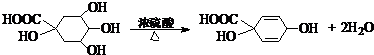 ,故答案为: 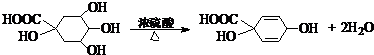 . |
参考解析:
无
【简答题】

[2/833]13.0g锌与100mL稀盐酸恰好完全反应,最多可收集到多少体积(标准状况)的氢气?盐酸的物质的量浓度是多少?
参考答案:
n(Zn)=
Zn+2HCl=ZnCl2+H2↑ 1mol 2mol22.4L 0.2mol n(HCl) V(H2) V(H2)=
n(HCl)=0.4mol, c(HCl)=
答:最多可收集到4.48L(标准状况)的氢气,盐酸的物质的量浓度是4mol/L. |
参考解析:
13.0g65g/mol
【简答题】

[3/833]m mol C2H2跟n mol H2在密闭容器中反应,生成p mol C2H4.将反应后的混合气体完全燃烧,生成CO2...
参考答案:
| 无论乙炔和氢气反应程度如何,根据原子守恒,混合物中各元素的原子个数不变,物质的量不变.碳氢元素的物质的量分别为: C2H2~2C~2H 1 2 2 mmol 2mmol 2mmol H2~2H 1 2 nmol 2nmol 所以混合物中碳原子的物质的量为2mmol,氢原子的物质的量为(2m+2n)mol, 根据碳氢元素完全燃烧可知C+O2
所以混合气体完全燃烧所需氧气为2mmol+
故选C. |
参考解析:
| 点燃 |
| . |
【简答题】

[4/833]8.4g单质A能从足量的盐酸中置换出3.36L(标准状况下)的H2,同时生成ACl2;另一种元素B的最高价氧化物的化学式为BO3.在B的氢化物中,B的...
参考答案:
| (1)设A、B的相对原子质量分别为MA、MB,则有: A+2HCl=ACl2+H2↑ MAg 22.4L 8.4g3.36L 所以MAg:8.4g=22.4L:3.36L,解得MA=56,故A为Fe, 据题意可知,B的氢化物的化学式为H2B,故有2:MB=(1-94.1%):94.1%,解得MB≈32,故B为S, 故答案为:56,Fe;32,S; (2)Fe与S发生反应Fe+S
 , ,故答案为:  . . |
参考解析:
| △ |
| . |
【简答题】

[5/833]把5.4g铝放入足量的NaOH溶液中,充分反应.计算参加反应的NaOH的物质的量,以及生成H2的体积(标况).
参考答案:
5.4gAl的物质的量为
令消耗氢氧化钠的物质的量为xmol,生成氢气的物质的量为ymol,则: 2Al+2NaOH+2H2O═2NaAlO2 +3H2↑ 2mol 2mol3mol 0.2mol xmolymol 所以,x=0.2mol,y=
标准状况下生成氢气的体积为0.3mol×22.4L/mol=6.72L, 答:参加反应的NaOH的物质的量为0.2mol,标准状况下生成氢气的体积为6.72L. |
参考解析:
5.4g27g/mol
【简答题】

[6/833]甲、乙两烧杯中各盛放有100mL 3mol•L-1的盐酸和氢氧化钠溶液,向两烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为甲:...
参考答案:
| 盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol, 又两烧杯中分别加入等质最的铝粉,反应结束后测得生成的气体体积比为甲:乙=1:2, 设铝与酸反应时酸完全反应,生成的氢气的物质的量为x, 则 2Al+6HCl═2AlCl3+3H2↑ 6 3 0.3mol x
一定条件下,气体的物质的量之比等于体积之比, 则碱与金属铝反应生成的氢气的物质的量为0.15mol×2=0.3mol, 碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y, 则 2Al+2NaOH+2H2O═2NaAlO2+3H2↑ 2 3 y 0.3mol
则铝的质量为0.2mol×27g/mol=5.4g, 故选A. |
参考解析:
63
【简答题】

[7/833]将一块质量为8.5g在空气中部分氧化的钠块,投入到91.51g水中,充分反应后共收集到标准状况下的气体1.12L,求:(1)被氧化的钠的质量.____...
参考答案:
| (1)设产生1.12L氢气需钠的质量为x,则: 2Na+2H2O=2NaOH+H2↑ 46g22.4L x 1.12L 所以,46g:x=22.4L:1.12L 解得:x=2.3g, 则氧化钠的质量是:8.5g-2.3g=6.2g, 则对应的被氧化的钠的质量为
故答案为:4.6g; (2)钠块中n(Na)=
根据钠原子守恒可知n(NaOH)=0.1mol+0.1mol×2=0.3mol,则m(NaOH)=0.3mol×40g/mol=12g, 溶液质量=8.5g+91.51g-
故答案为:12.01%; (3)反应后的溶液加水稀释到200mL,稀释后NaOH的物质的量浓度=
故答案为:1.5mol/L. |
参考解析:
23×223×2+16
【简答题】

[8/833]0.1mol某饱和一元醛完全燃烧生成8.96L(标准状况)CO2.3.6克该醛跟足量银氨溶液反应,生成固体物质的质量是( ) A.10.8克B.7....
参考答案:
n(CO2)=
饱和一元醛的通式为CnH2n0, 则可知醛的分子式为C4H8O, 结构简式为CH3CH2CH2CHO, 3.6克该醛的物质的量为n(CH3CH2CH2CHO)=
反应的关系式为:CH3CH2CH2CHO~2Ag, 所以:生成n(Ag)=0.05mol×2=0.1mol, m(Ag)=0.1mol×108g/mol=10.8g, 故选A. |
参考解析:
8.96L22.4L/mol
【简答题】

[9/833]已知稀硝酸与铜反应时,NO3-一般被还原为NO;浓硝酸与铜反应时,NO3-一般被还原为NO2.现将25.6gCu投入到50mL 12mol/L的浓硝酸...
参考答案:
| 发生反应的方程式有:Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O n(Cu)=
(1)根据N原子守恒可知,被还原的硝酸的物质的量等于生成NO和NO2的物质的量, 即n(NO)+n(NO2)=
(2)设有amolCu被氧化,则生成2amolCu(NO3)2, 根据N元素守恒可知:n(Cu(NO3)2)+n(NO)+n(NO2)=0.6mol, 则有:2a+0.2=0.6,a=0.2, 即被氧化的Cu为0.2mol,则剩余0.4mol-0.2mol=0.2mol, 故答案为:Cu;0.2mol; (3)由题意可知:HNO3
即0.2molCu失去0.4mol电子,O2得到0.4mol电子,需氧气0.1mol,即2.24L标态氧气, 故答案为:2.24; (4)反应后溶液中含有n(NO3-)=0.4mol, 加入H+的物质的量为:n(H+)=2n(H2SO4)=2×0.2L×4mol/L=1.6mol, 剩余0.2molCu, 则:3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O 3 2 8 2 0.2mol 0.4mol 1.6mol n(NO) 由以上各物质的量可知,往反应后的体系内再加入200mL4mol/L的稀硫酸,Cu完全反应, 生成n(NO)=
V(NO)=0.133mol×22.4L/mol=2.99L, 答:生成气体在标况下的体积为2.99L. |
参考解析:
25.6g64g/mol
【简答题】

[10/833]下列化学方程式书写完全正确的一组是 [ ] ①铁丝在氧气中剧烈燃烧:4Fe﹢3O2 【图片】2Fe2O...
参考答案:
| D |
参考解析:
解:①铁丝在氧气中燃烧生成的是四氧化三铁而不是三氧化二铁,故①错误;
②二氧化碳和碳在高温的条件下生成一氧化碳,一氧化碳还原氧化铁,故②正确;
③氮肥碳酸氢铵与盐酸反应的方程式中盐酸前面不用加2,故③错误;
④酒精和氧气在点燃的条件下生成二氧化碳和水,故④正确。
故选D.
②二氧化碳和碳在高温的条件下生成一氧化碳,一氧化碳还原氧化铁,故②正确;
③氮肥碳酸氢铵与盐酸反应的方程式中盐酸前面不用加2,故③错误;
④酒精和氧气在点燃的条件下生成二氧化碳和水,故④正确。
故选D.

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





