
创建自己的小题库
搜索

能量的相互转化题库
题数
1708
考试分类
高中化学>能量的相互转化
售价
¥30
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-能量的相互转化
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【简答题】

[1/1708]化学与科学、技术、社会及生产、生活密切相关.下列说法中不正确的是( ) A.2010年上海世博会中国馆外墙使用的太阳能电池可将太阳能转化为电能B.合...
参考答案:
| A、电池是一种向外提供电能的装置,所以太阳能电池可将太阳能转化为电能,故A正确; B、催化剂能降低反应所需的活化能,使反应的有效碰撞几率增大,反应速率加快,催化剂对化学平衡没有影响,不能提高平衡转化率,故B正确; C、水分解成氢气和氧气为吸热反应,催化剂对反应的热效应无影响,所以加催化剂不能使水分解成氢气和氧气释放能量,故C错误; D、锂离子电池属于可充电电池,是二次电池,故D正确; 故选:C. |
参考解析:
无
【简答题】

[2/1708]下列说法中不正确的是( ) A.当反应的△H<0时,该反应为放热反应B.常温下,放热反应都一定很容易发生C.若反应物的总键能大于生成物的总键能,则该...
参考答案:
| A.△H<0时,该反应为放热反应,故A正确; B.常温下,放热反应不一定很容易发生,如铝热反应,故B错误; C.反应物的总键能大于生成物的总键能,则该反应为吸热反应,故C正确; D.在热化学方程式中,物质化学式前面的化学计量数只表示物质的量,不表示分子数,故D正确; 故选B. |
参考解析:
无
【简答题】

[3/1708]关于下图,下列说法不正确的是 【图片】A.△E1是该反应的活化能B.△E2是破坏2mol HCl(g)所需的能量C.该反应的热化学方程式为H2+Cl2...
参考答案:
|
C
|
参考解析:
热化学方程式需标注反应物生成物状态;
C.该反应的热化学方程式为H 2(g)+Cl 2(g)=2 HCl (g) △H=-183KJ/mol。
C.该反应的热化学方程式为H 2(g)+Cl 2(g)=2 HCl (g) △H=-183KJ/mol。
【简答题】

[4/1708]关于化学反应,下列叙述中不正确的是 ( ) ①放热的反应发生时不必加热 ②化学反应...
参考答案:
|
C
|
参考解析:
放热反应有的不需要加热就能发生、有的需要加热引发其发生,①错误;化学反应的实质是旧键的断裂与新键的形成,断键吸热、成键放热,所以化学反应一定有能量变化,②正确;吸热反应有的不需要加热就能发生,有的需要加热才能发生,③错误;化学反应热效应与反应物和生成物能量有关,与参加反应的物质的多少无关,④正确;
点评:放热反应不一定不需要加热,如铝热反应需用氯酸钾和镁条引发其发生;吸热反应不一定需要加热,如氯化铵与氢氧化钡晶体混合搅拌即可发生反应。
【简答题】

[5/1708]相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应: X 2(g) + 3Y 2(g) 【图片】 2XY 3(g) ...
参考答案:
|
B
|
参考解析:
A.因为同一反应在相同的温度下的平衡常数不变,故容器①、②中反应的平衡常数相等,正确;B.容器②中反应可视为是容器①已经反应了一部分,故达到平衡时放出的热量Q<23.15kJ,原说法不正确;C.容器①、②中达平衡时的等效的,由①可知生成n(XY 3)=
 ×2mol=0.5mol,故c(XY
3)=
×2mol=0.5mol,故c(XY
3)=
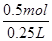 =2 mol·L
-1,正确;D.若容器①体积为0.20 L,相当于原反应缩小体积,加压,平衡正向移动,故放出的热量大于23.15 kJ,正确。
=2 mol·L
-1,正确;D.若容器①体积为0.20 L,相当于原反应缩小体积,加压,平衡正向移动,故放出的热量大于23.15 kJ,正确。
【简答题】

[6/1708]已知中和热的数值是57.3 kJ·mol –1。下列物质反应时,产生57.3 kJ热量的是 A.稀HCl和稀NaOHB.1.0 mol·L-1 HCl...
参考答案:
|
C
|
参考解析:
中和热是在一定条件下,稀溶液中,强酸和强碱反应生成1mol水时所放出的热量。A、B中无法确定生成水的物质的量,不正确;C中恰好生成1mol水,正确;D中生成2mol的水,放出的热量是57.3 kJ×2,D不正确,答案选C。
点评:该题是中等难度的试题,试题基础性强,侧重对学生基础知识的巩固与训练,同时兼顾能力的培养。该题的关键是明确中和热的含义,然后结合题意灵活运用即可。
【简答题】

[7/1708]下列说法或表示方法中正确的是( ) A.吸热反应中,新化学键形成吸收能量;放热反应中,新化学键形成放出能量B.等质量的硫蒸气和硫磺分别完全燃烧,后者...
参考答案:
| A、化学反应中能量变化的原因:旧键断裂要吸收能量,新键形成要吸收能量,所以吸热反应和放热反应中新化学键形成都放出能量,故A错误; B、气态硫具有的能量高,燃烧时放出热量多,所以等质量的硫蒸气和硫磺分别完全燃烧,前者放出的热量多,故B错误; C、醋酸是弱电解质电离时吸热,所以醋酸溶液与足量的NaOH稀溶液反应放出的热量小,故C正确; D、燃烧热是指1mol可燃物完全燃烧生成稳定的氧化物所放出的热量,氢气的燃烧热为285.8 kJ/mol,则氢气燃烧的热化学方程式为:H2(g)+
故选C. |
参考解析:
12
【简答题】

[8/1708]下列说法正确的是 [ ] A.任何反应中的能量变化都表现为热量变化 B.物质发生化学变化都伴随着能量变...
参考答案:
| B |
参考解析:
无
【简答题】

[9/1708]通常人们把拆开1mol化学键所吸收的能量看成键能,键能的大小可以衡量化学键的强弱,也可以用于计算化学反应中的反应热(△H),化学反应中的△H等于反应中...
参考答案:
| △H=360kJ/mol×4+436kJ/mol×2-176kJ/mol×2-431kJ/mol×4=+236kJ/mol, 答:该反应的反应热△H=+236kJ/mol. |
参考解析:
无
【简答题】

[10/1708]下列关于化学反应与能量的说法正确的是 A.燃烧反应不一定是放热反应B.化学反应一定既有物质变化又有能量变化C.反应物断键所吸收的总能量高于生成物形成键...
参考答案:
|
B
|
参考解析:
略

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





