
创建自己的小题库
搜索

设计实验方案及探究实验题库
题数
2000
考试分类
高中化学>设计实验方案及探究实验
售价
¥30
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-设计实验方案及探究实验
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【简答题】

[1/2000]锗(Ge)是第ⅣA族元素,它的单质是一种良好的半导体材料,被广泛地应用在电子工业上,锗可以从烟道灰中提取,其过程如下: 【图片】(1)写出上述各步反应...
参考答案:
| (1)①锗最外层有4个电子,所以其最高价为+4,锗的最高价氧化物为GeO2,与HCl(aq)发生复分解反应,生成的氯化物应为GeCl4和H2O,反应方程式为:GeO2+4HCl═GeCl4+2H2O. 故答案为:GeO2+4HCl═GeCl4+2H2O. ②GeCl4水解反应:GeCl4+4H2O  Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,原锗酸H4GeO4失水变为锗酸H2GeO3,反应方程式为GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl ) 故答案为:GeCl4+4H2O═H4GeO4+4HCl、H4GeO4═H2GeO3+H2O(或GeCl4+3H2O═H2GeO3+4HCl ). ③GeCl4水解反应:GeCl4+4H2O  Ge(OH)4+4HCl(正反应吸热),生成原锗酸H4GeO4与HCl,加热平衡向右移动,HCl逸出,且水分不断蒸发,原锗酸H4GeO4失水变为锗酸H2GeO3,H4GeO4失水变为锗酸H2GeO3,锗酸受热分解为GeO2. 锗酸受热分解为GeO2与水,反应方程式为H2GeO3
故答案为:H2GeO3
④GeO2与H2发生氧化还原反应,H2夺去GeO2中的O生成H2O,Ge被还原出来.反应方程式为GeO2+2H2
故答案为:GeO2+2H2
(2)前三步的主要作用是分离、提纯和富集锗的氧化物. 第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用. 故答案为:前三步的主要作用是分离、提纯和富集锗的氧化物. 第②步中产生的盐酸可以循环到第①步中使用,①③④中产生的水也可以循环到第②步使用. |
参考解析:
无
【简答题】

[2/2000]某同学设计了如下实验,以测定CaCO 3、(NH 4) 2CO 3和NH 4Cl固体混合物中氮元素的质量分数。实验过程如下图所示: 【图片】请回答: ...
参考答案:
|
(1)烧杯、漏斗、玻璃棒(共3分)(2)
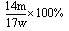 (1分) (1分)
(3)a、b、c (共3分) |
参考解析:
无
【简答题】

[3/2000]Ⅰ.某矿样含有大量的CuS、少量铁的氧化物及少量其它不溶于酸的杂质。某化学课外小组设计以下流程,以该矿样为原料生产CuCl 2·2H 2O晶体。 【图...
参考答案:
|
(14分)
Ⅰ. (1)AB(2分) (2)量筒、100mL容量瓶(2分) (3) CuO[或Cu(OH) 2、CuCO 3、Cu 2(OH) 2CO 3等合理答案](2分); 调节溶液的pH,除去Fe 3+(1分) Ⅱ. (1)品红溶液(1分) (2)abfgd(2分) (3)向E中逐滴加入氯化钡溶液,直到不再产生新的沉淀为止。(2分) (4) c×152×2/233g(2分) |
参考解析:
无
【简答题】

[4/2000]铝镁合金已成为轮船制造、化工生产等行业的重要材料。研究性学习小组为测定某含镁3%一5%的铝镁合金(不含其它元素)中镁的质量分数,设计以下实验方案进行探...
参考答案:
|
[交流与讨论](1)2Al+2NaOH+2H
2O=2NaAlO
2+3H
2 ↑ (2)97mL
(3)滤纸破损;过滤时漏斗里的液面高于滤纸边缘;仪器不干净等 (4)偏高 [实验拓展] 
|
参考解析:
本题考查镁铝合金中镁的质量分数的测定。(1)金属铝与氢氧化钠反应生成氢气;(2)极值法考虑,设5.4g合金中含有镁的量为3%,则金属铝的物质的量为:
 mol=0.194mol,需要氢氧化钠的物质的量为0.194mol,体积为:
mol=0.194mol,需要氢氧化钠的物质的量为0.194mol,体积为:
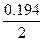 L=0.097L;(3)滤液仍浑浊,说明滤液中仍然有金属镁,过滤操作有误;(4)若没有洗涤,则镁的质量偏大,所得质量分数也偏高。
L=0.097L;(3)滤液仍浑浊,说明滤液中仍然有金属镁,过滤操作有误;(4)若没有洗涤,则镁的质量偏大,所得质量分数也偏高。
【简答题】

[5/2000](10分)工业上利用含锰废水(主要含MnSO 4、H 2SO 4、和铁、铝、铜等金属的硫酸盐)制取碳酸锰(MnCO 3)。步骤如下: Ⅰ.氧化:向废水...
参考答案:
|
(10分)(每空2分)
(1) b (2) Al 3+ + 3NH 3·H 2O ="=" Al(OH) 3 ↓ + 3NH 4 + (3)过滤 (4)Mn 2+ + 2 HCO 3 - ="=" MnCO 3 ↓ + H 2O + CO 2 ↑ (5)261.0 |
参考解析:
(1)只能用双氧水来氧化,另外两种物质虽能氧化亚铁离子,但是又引入了新的杂质。
(5)MnCO 3 → MnO 2 + CO。MnCO 3的物质的量为4000mol,如果产物全是MnO 2,产物质量应为348.0Kg,因为有杂质MnO,产物质量为332.0Kg,MnO的物质的量为:
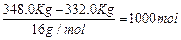 。依据质量守恒,MnO
2物质的量为3000mol,质量为261.0Kg。
。依据质量守恒,MnO
2物质的量为3000mol,质量为261.0Kg。
(5)MnCO 3 → MnO 2 + CO。MnCO 3的物质的量为4000mol,如果产物全是MnO 2,产物质量应为348.0Kg,因为有杂质MnO,产物质量为332.0Kg,MnO的物质的量为:

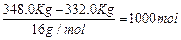 。依据质量守恒,MnO
2物质的量为3000mol,质量为261.0Kg。
。依据质量守恒,MnO
2物质的量为3000mol,质量为261.0Kg。
【简答题】

[6/2000]下列图中的实验方案,能达到实验目的的是 【图片】
参考答案:
|
A
|
参考解析:
A.2NO 2(g)
 N
2O
4.(g) ΔH<O. 将两个NO
2平衡球分别放在热水、冰水中。平衡球放在热水中颜色加深,放在冰水中颜色变浅。说明升高温度,化学平衡向逆反应方向移动,降低温度,化学平衡向正反应方向移动。可见是温度不同化学反应移动的方向不同。正确。B.在复分解反应中,一般是强酸制取弱酸。发生反应:2HCl+Na
2CO
3=2NaCl+H
2O+CO
2↑证明:酸性HCl >H
2CO
3;H
2O+CO
2+Na
2SiO
3= Na
2CO
3+H
2SiO
3↓. 证明:酸性H
2CO
3>H
2SiO
3。但由于HCl有挥发性,挥发出的HCl也会与Na
2SiO
3发生反应:2HCl+Na
2SiO
3="2NaCl+" H
2SiO
3↓.故不能证明酸性:HCl >H
2CO
3>H
2SiO
3。错误。C.CO
2、SO
2都会与溶液中的Na
2CO
3反应。因此不能达到除去杂质的目的。错误。要验证FeCl3溶液对H2O2的分解有催化作用,应该是其它外界条件相同,只有一个加催化剂,另一个对比的不加催化剂才可以,不能同时有两个变量。错误。
N
2O
4.(g) ΔH<O. 将两个NO
2平衡球分别放在热水、冰水中。平衡球放在热水中颜色加深,放在冰水中颜色变浅。说明升高温度,化学平衡向逆反应方向移动,降低温度,化学平衡向正反应方向移动。可见是温度不同化学反应移动的方向不同。正确。B.在复分解反应中,一般是强酸制取弱酸。发生反应:2HCl+Na
2CO
3=2NaCl+H
2O+CO
2↑证明:酸性HCl >H
2CO
3;H
2O+CO
2+Na
2SiO
3= Na
2CO
3+H
2SiO
3↓. 证明:酸性H
2CO
3>H
2SiO
3。但由于HCl有挥发性,挥发出的HCl也会与Na
2SiO
3发生反应:2HCl+Na
2SiO
3="2NaCl+" H
2SiO
3↓.故不能证明酸性:HCl >H
2CO
3>H
2SiO
3。错误。C.CO
2、SO
2都会与溶液中的Na
2CO
3反应。因此不能达到除去杂质的目的。错误。要验证FeCl3溶液对H2O2的分解有催化作用,应该是其它外界条件相同,只有一个加催化剂,另一个对比的不加催化剂才可以,不能同时有两个变量。错误。
【简答题】

[7/2000]动手实践:某同学做同周期元素性质递变规律实验时,自己设计了一套实验方案,并记录了有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应...
参考答案:
| (1)同周期 (2)试管;烧杯;酒精灯 |
(3) |
①Mg+2H2O 2Mg(OH)2+H2↑ ②Na2S+Cl2==2NaCl+S↓ 2Mg(OH)2+H2↑ ②Na2S+Cl2==2NaCl+S↓(4)Na>Mg>Al;Cl>S |
参考解析:
无
【简答题】

[8/2000]现用如下实验装置测定铜和氧化铜混合物中铜元素的含量。 【图片】试回答下列问题: (1)A中盛装盐酸的仪器名称为 &...
参考答案:

|
参考解析:
无
【简答题】

[9/2000]某校研究性学习小组通过在相同条件下,金属与酸反应产生H2的快慢,比较Al和Fe的金属性强弱,设计了如下实验装置进行实验 【图片】 (1)上图中仪器A的...
参考答案:
| (1)锥形瓶;稀盐酸(HCl)或稀硫酸(H2SO4) (2)如图组装好仪器,把丙中导管插入盛水的烧杯中,用热毛巾捂住锥形瓶,若导管口有气泡冒出,冷却后,导管内形成一段高于烧杯内水面的水柱,则装置的气密性好(合理即可) (3)测量产生相同体积的氢气,两种金属所需时间长短 (4)②③ |
参考解析:
无
【简答题】

[10/2000]以下实验或操作不能达到目的的是 A.用铜片(必要时可加热)鉴别浓硝酸、稀硝酸、浓硫酸和浓盐酸B.用品红溶液鉴别乙醛、苯、硝基苯C.用10mL量筒准确量...
参考答案:
|
C |
参考解析:
无

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





