
创建自己的小题库
搜索

羧酸的通性题库
题数
148
考试分类
高中化学>羧酸的通性
售价
¥15
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-羧酸的通性
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【简答题】

[1/148]过氧乙酸(CH3COOOH)是一种高效消毒剂,具有很强 的氧化性和腐蚀性,可以迅速杀灭多种微生物,包括多 种病毒(如SARS病毒)、细菌、真菌及芽孢。...
参考答案:
| B |
参考解析:
无
【简答题】

[2/148]癌症(恶性肿瘤)严重威胁着人类的生命。据报道,每年因癌症而死亡的人数呈递增趋势。为了战胜癌症,科学家正致力于研究癌症发生的机理和研制抗癌药物,以挽救人...
参考答案:
| (1)C31H38O11 (2)①②③④ (3)1 (4)不能 (5)  +HCl+H2O→ +HCl+H2O→ |
参考解析:
无
【简答题】

[3/148]近年来流行喝果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品。苹果酸(α-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸...
参考答案:
| D |
参考解析:
无
【简答题】

[4/148]癌症严重地威胁着人类的生命,由于地球环境恶化,臭氧层空洞扩大,每年因患病而死亡的人呈递增趋势。据统计1998年世界因患各种癌症而死亡的人数高达127万...
参考答案:
(1) (2)氨基不在α位 (3)C31H38O11 |
参考解析:
无
【简答题】

[5/148]在阿司匹林的结构简式(下式)中①②③④⑤⑥分别标出了其分子中的不同的键。将阿司匹林与足量NaOH溶液共同加热时,发生反应时断键的位置是 【图片】 [&...
参考答案:
| D |
参考解析:
无
【简答题】

[6/148]一定量某有机物溶解于适量NaOH溶液中,滴入酚酞,溶液呈红色,煮沸5 min后,溶液颜色逐渐变浅,再加入盐酸显酸性时,沉淀出白色晶体,取少量...
参考答案:
| A |
参考解析:
无
【简答题】

[7/148]使用有机材料制成的薄膜,给环境造成的“白色污染”后果十分严重。我国最近研制成功的一种可降解塑料结构如下 【图片】 该塑料有良好的生物适应性和分解性,能...
参考答案:
(1)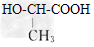 ; ;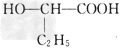 ; ;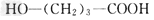 (2)水解反应 (3) 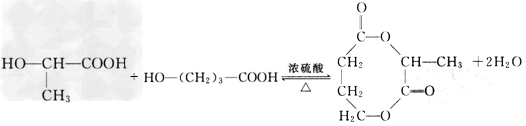 (4)CH3-CH=CH-COOH;2 |
参考解析:
无
【简答题】

[8/148]下列物质之间的相互转化不符合“ 【图片】”(“→”表示一步反应)的是 【图片】 [ ] A...
参考答案:
| B |
参考解析:
无
【简答题】

[9/148]某有机物的结构简式如下式,该有机物不可能具有的性质是 【图片】 [ ] A.能跟NaOH溶液反应 B....
参考答案:
| D |
参考解析:
无
【简答题】

[10/148]甲酸(CH2O2),俗称蚁酸,结构式为:______.某化学兴趣小组的同学在分析甲酸的组成和结构后,对甲酸的性质提出如下猜想并设计了相关实验加以验证:...
参考答案:
| (1)根据酸的通性分析,如甲酸呈酸性,则在溶液中电离出氢离子,用PH试纸检验变红色,能与碱发生中和反应,能与碳酸盐反应生成二氧化碳气体,故答案为:测定pH或滴加Na2CO3溶液、或将甲酸滴加到滴有酚酞的NaOH溶液中; (2)如甲酸为弱酸,则其钠盐溶液水解呈碱性,将等pH的HCOOH溶液和HCl溶液稀释相同倍数时,PH变化不同,强酸PH变化较大,弱酸PH变化较小,溶液的导电性不同, 故答案为:测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等; (3)甲酸的结构为  ,分子中含有醛基、羧基、羰基和羟基,应具有还原性和酸性等性质,实验Ⅱ中没有出现预期的现象的可能原因是羟基的影响,另外进行银镜反应时,须在碱性条件下反应,如稀氨水量不足,则无银镜产生, 故答案为:出现银镜;由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质;羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型;或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性; (4)①根据浓硫酸具有脱水性,以及甲酸的分子式为CH2O2,根据质量守恒可推测甲酸在浓硫酸的作用下脱水生成CO和H2O,故答案为:甲酸在浓硫酸的作用下脱水生成CO和H2O; ②甲酸在浓硫酸作用下生成一氧化碳和水,可用无水硫酸铜检验水的生成,然后通过CuO固体,在加热条件下反应,观察固体颜色的变化,并将生成的气体通入澄清石灰水观察是否变浑浊,故答案为:  |
参考解析:
无

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





