
创建自己的小题库
搜索

沉淀溶解平衡题库
题数
1008
考试分类
高中化学>沉淀溶解平衡
售价
¥30
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-沉淀溶解平衡
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【简答题】

[1/1008]向5mL 0.2mol/L的盐酸中加入5mL0.18mol/L AgNO3溶液生成沉淀,则生成沉淀后溶液中Ag+的物质的量浓度为(...
参考答案:
| 5mL 0.2mol/L的盐酸中加入5mL0.18mol/L AgNO3溶液加入后两者浓度分别为 c(Ag+)=
c(Cl-)=
Ag+与Cl-是等物质的量反应的,此时Cl-过量,过量浓度c(Cl-)=0.1-0.09=0.01(mol/L) 已知:C(Ag+)×C(Cl-)=1.8×10-10, 则:C(Ag+)=
故选D. |
参考解析:
无
【简答题】

[2/1008]运用化学反应原理研究氢、氧、氯、碘等单质及其化合物的反应有重要意义 (1)已知:25℃时K SP(AgCl)=1.6×l0 -10 &nbs...
参考答案:
|
(10分)
(1)Q (AgCl)= c(Ag +)·c (Cl -)= 1×l0 -6>K sp(AgCl) (2分) 白色沉淀转化为黄色沉淀 (2分) AgCl(s) + I -(aq) == AgI(s) + Cl -(aq) (2分,不标s扣1分,不标aq不扣分) (2)D(2分) (3)B(2分) |
参考解析:
无
【简答题】

[3/1008]已知下列物质在20 ℃下的Ksp如下,试回答下列问题 【图片】 (1)20 ℃时,上述五种银盐饱和溶液中,Ag+物质的量浓度由大到...
参考答案:
| (1)Ag2CrO4>AgCl>AgBr>AgI>Ag2S (2)2.7×10-3 (3)D |
参考解析:
无
【简答题】

[4/1008]常温下,AgI的溶度积是8.3×10 -17,在该温度下把0.01L浓度为8.0× 10 -6mol/L的AgNO 3溶液和0.01L浓度为4.0×1...
参考答案:
|
D
|
参考解析:
无
【简答题】

[5/1008]医学上在进行胃肠疾病的检查时,利用X射线对BaSO4穿透能力较差的特性,常用BaSO4做内服造影剂,这种检查手段称为钡餐透视。(1)请写出BaSO4能...
参考答案:
| (1)BaSO4既不溶于水,也不溶于酸,可经人体排出体外,不会引起Ba2+中毒 (2)BaCO3遇到胃酸生成Ba2+会使人中毒,反应离子方程式为:BaCO3+2H+=Ba2++H2O+CO2↑ (3)①A;C;②5.5×10-10mol·L-1;2.2×10-10mol·L-1;③13 |
参考解析:
无
【简答题】

[6/1008]某化工厂生产皓矾(ZnSO4•7H2O),结晶前的饱和溶液(呈酸性)中含有少量Cu2+、Fe3+、Fe2+等杂质.已知0.01mol/L的Fe3+开始...
参考答案:
| (1)需先将Fe2+氧化为Fe3+,然后再将Fe3+转化为Fe(OH)3沉淀除去,在选择氧化剂时,既要能氧化Fe2+又不引入新的杂质,不宜选用Cl2、KMnO4、HNO3等氧化剂,加入的试剂②为双氧水(H2O2的水溶液)最适宜, 故答案为:过氧化氢; 将Fe2+氧化成Fe3+; (2)只要调整溶液的pH在2.7~5.7的范围内,Fe3+可以完全沉淀而除去,Zn2+不会沉淀,加入的试剂③是ZnCO3,能控制pH在5.7附近,且不引入杂质离子, 故答案为:ZnCO3; 能控制pH在5.7附近,且不引入杂质离子; (3)从溶液中获得皓矾,应先将溶液进行蒸发浓缩,冷却后进行结晶,然后过滤,由于固体具有吸附能力,固体表面吸附溶液中的离子,最后要进行洗涤. 故答案为:蒸发、冷却、过滤、洗涤. |
参考解析:
无
【简答题】

[7/1008]常温下,AgCl、AgBr、AgI的溶度积(Ksp)依次为1.8×10 【图片】、5.0×10 【图片】、8.3×10 【图片】。下列有关说法错误的是...
参考答案:
|
C
|
参考解析:
答案:C
AgBr+Cl ―
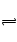 AgCl+Br
―沉淀转换平衡,也是可逆反应,改变条件可使平衡向某个方向移动。C,只要提高Cl
―的浓度,平衡就可以向生成AgCl的方向移动。
AgCl+Br
―沉淀转换平衡,也是可逆反应,改变条件可使平衡向某个方向移动。C,只要提高Cl
―的浓度,平衡就可以向生成AgCl的方向移动。
【简答题】

[8/1008]难溶性杂卤石(K 2SO 4·MgSO 4·2CaSO 4·2H 2O)属于“呆矿”,在水中存在如下溶解平衡: K 2SO 4·MgSO 4·2CaS...
参考答案:
|
(1)Mg(OH)
2(1分) (2)加入Ca(OH)
2溶液,Mg
2
+与OH
-结合生成Mg(OH)
2沉淀,Mg
2
+浓度减小,平衡正向移动,K
+增多(2分) (3)K
2CO
3(1分) H
2SO
4(1分)
(4)①溶浸平衡向右移动(1分) ②K +的溶浸速率增大(1分) (5) K=1.75×10 4。(2分) |
参考解析:
(1)“呆矿”在水中存在沉淀溶解平衡K 2SO 4·MgSO 4·2CaSO 4·2H 2O(s)
 2Ca
2
++2K
++Mg
2
++4SO
4
2-+2H
2O,为能充分利用钾资源,用饱和Ca(OH)
2溶液溶浸杂卤石制备硫酸钾,氢氧根离子和镁离子结合生成氢氧化镁沉淀,同时钙离子增多,析出硫酸钙沉淀,所以滤渣中主要成分为Mg(OH)
2和CaSO
4以及未溶杂卤石。
2Ca
2
++2K
++Mg
2
++4SO
4
2-+2H
2O,为能充分利用钾资源,用饱和Ca(OH)
2溶液溶浸杂卤石制备硫酸钾,氢氧根离子和镁离子结合生成氢氧化镁沉淀,同时钙离子增多,析出硫酸钙沉淀,所以滤渣中主要成分为Mg(OH)
2和CaSO
4以及未溶杂卤石。
(2)Ca(OH) 2溶液能溶解杂卤石浸出K +的原因是氢氧化钙是饱和溶液,加入后氢氧根离子和镁离子结合生成氢氧化镁沉淀,促进平衡右移,增多K +。
(3))“除杂”环节主要是除去钙离子,依据除杂原则不能引入新的杂质,根据制取的目的是制备硫酸钾,所以加入的试剂易于除去,不引入新的杂质,因此加入过量K 2CO 3除钙离子,过滤后加入硫酸至中性,除去碳酸钾即可。
(4)分析不同温度下,K +的浸出浓度与溶浸时间的关系,温度越高K +的浸出浓度越大,溶浸时间越短,反应速率越大,达到平衡越快,故图象中分析得到的结论为:①溶浸平衡向右移动;②K +的溶浸速率增大。
(5)溶浸过程中会发生反应CaSO 4(s)+CO 3 2-
 CaCO
3(s)+SO
4
2-,CaCO
3(s)
CaCO
3(s)+SO
4
2-,CaCO
3(s)
 Ca
2++CO
3
2-;CaSO
4(s)
Ca
2++CO
3
2-;CaSO
4(s)
 Ca
2++SO
4
2-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=
Ca
2++SO
4
2-;依据硫酸钙、碳酸钙溶度积常数的计算表达式,转化关系中钙离子相同计算,反应的平衡常数K=
 =
=
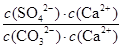 =
=
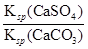 =
=
 =1.75×10
4
。
=1.75×10
4
。
【简答题】

[9/1008]常温下, Ksp (CaSO4)=9´10 -6,常温下CaSO 4在水中的沉淀溶解平衡曲线见图。下列说法正确的是 【图片】A.常温下CaSO4饱和溶...
参考答案:
|
D
|
参考解析:
A.常温下CaSO
4饱和溶液中,对应c(Ca
2+)=c(SO
4
2—)=3´10
-
3 mol·L
—1的这一点,不正确
B:B点溶液中离子积大于9×10 -6,所以一定有沉淀析出。由于起始时c(SO 4 2-)小于c(Ca 2 +),所以平衡时c(SO 4 2-)仍然小于c(Ca 2 +),即c(SO 4 2-)小于3×10 -3 mol/L,B不正确
C:蒸发过程中c(SO 4 2-)应该是增大的,所以选项C不正确。
D:溶度积常数只与温度有关系,所以选项D正确
答案为D
B:B点溶液中离子积大于9×10 -6,所以一定有沉淀析出。由于起始时c(SO 4 2-)小于c(Ca 2 +),所以平衡时c(SO 4 2-)仍然小于c(Ca 2 +),即c(SO 4 2-)小于3×10 -3 mol/L,B不正确
C:蒸发过程中c(SO 4 2-)应该是增大的,所以选项C不正确。
D:溶度积常数只与温度有关系,所以选项D正确
答案为D
【简答题】

[10/1008]下列说法正确的是( ) A.常温下,将pH=11的氨水稀释到原体积的10倍后,溶液的pH=10B.为确定某酸.H2A是强酸还是弱酸,可测NaHA溶液...
参考答案:
A.一水合氨是弱电解质,加水稀释氨水会促进一水合氨电离,导致氢氧根离子浓度大于原来的
B、NaHA溶液的pH>7说明H2A的二级电离不完全,即HA-为弱酸,所以可以说明H2A是弱酸,NaHA溶液的pH<7,H2A是强酸或弱酸都有可能,如硫酸、亚硫酸,故B错误; C、NaOH滴定HCl与CH3COOH,醋酸是弱电解质,若碱与酸恰好反应,溶液中溶质为氯化钠、醋酸钠,醋酸根水解溶液呈碱性,反应呈中性,溶液中的酸有剩余,故C正确; D、氯化银难溶于水,在水中的溶解度很小,一定温度下,溶液中Ksp(AgCl)=c(Ag+)•c(Cl-)为定值,①蒸馏水中没有氯离子、②0.1mol/L盐酸中c(Cl-)=0.1mol/L,③0.1 mol/L氯化镁溶液c(Cl-)=0.2mol/L、④0.1mol/L硝酸银溶液中c(Ag+)=0.1mol/L,溶液中c(Ag+)为④>①>②>③,故D错误. 故选:C. |
参考解析:
110

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





