
创建自己的小题库
搜索

环保工程(普通化学)题库
题数
72
考试分类
环保工程(普通化学)
售价
¥10
 手机预览
手机预览
收藏
分享
去刷题
简介
环保工程(普通化学)
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【单选题】

[1/72]已知K a(HAc)为1.8×10 -5,若用HAc和NaAc配制成pH=5的缓冲溶液,则HAc的浓度与NaAc的浓度之比正确的为()。
A.
8:9
B.
9:8
C.
5:9
D.
9:5
参考答案:
C
参考解析:
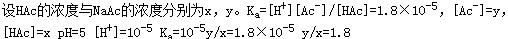
【单选题】

[2/72]已知电极反应 【图片】,其氧化还原电对的符号正确的是()。
A.
H2O2/H2O
B.
H2O2/O2
C.
O2/H2O2
D.
H2O/H2O2
参考答案:
B
参考解析:
H2O2和O2分别为电子供体和电子受体,H2O2发生氧化反应,书写在左边,O2发生还原反应,书写在右方。
【单选题】

[3/72]下列离子中半径最小的是()。
A.
Ca2+
B.
Sc3+
C.
Ti3+
D.
Ti4+
参考答案:
D
参考解析:
周期表中同周期电子层结构相同的阳离子半径,随着电荷数增加而减小,对于同一元素,失去电子越多,离子半径总是随着正电荷的增加而减小。
【单选题】

[4/72]【图片】的正确名称是()。
A.
1-甲基-3-乙基环戊烷
B.
顺-1-甲基-4-乙基环戊烷
C.
反-1-甲基-3-乙基戊烷
D.
顺-1-甲基-3-乙基环戊烷
参考答案:
D
参考解析:
按照系统命名法的规则来命名。故选(D)。
【单选题】

[5/72]下列各组元素,按电离能增加的顺序排列的是()。
A.
Li、Na、K
B.
Be、Li
C.
O、F、Ne
D.
C、P、Se
参考答案:
C
参考解析:
(1)同周期主族元素从左到右作用到最外层电子上的有效核电荷逐渐增大,电离能也逐渐增大,到稀有气体由于具有稳定的电子层结构,其电离能最大。故同周期元素从强金属性逐渐变到非金属性,直至强非金属性。 (2)同周期副族元素从左至右,由于有效核电荷增加不多,原子半径减小缓慢,有电离能增加不如主族元素明显。由于最外层只有两个电子,过渡元素均表现金属性。 (3)同一主族元素从上到下,原子半径增加,有效核电荷增加不多,则原子半径增大的影响起主要作用,电离能由大变小,元素的金属性逐渐增强。
【单选题】

[6/72]已知 【图片】的△rHθ=-305.3kJ·mol-1,PbSO4(s)的生成热为()。
A.
-910kJ·mol-1
B.
926kJ·mol-1
C.
-916kJ·mol-1
D.
-923kJ·mol-1
参考答案:
C
参考解析:

【单选题】

[7/72]下列物质呈固态时,属于分子晶体的是()。
A.
Si
B.
NaF
C.
l4
D.
Fe
参考答案:
C
参考解析:
不难看出Si靠共价键,NaF是靠离子键,Fe是靠金属键,都不能形成分子晶体,只有CCl4是靠分子间力,一定是分子晶体。故选(C)。
【单选题】

[8/72]某一元弱酸,浓度为0.1mol・L -1,该溶液的pH=5.15,该一元弱酸的Ka值是()。
A.
5×10-10
B.
4×10-10
C.
5×10-9
D.
4×10-9
参考答案:
A
参考解析:
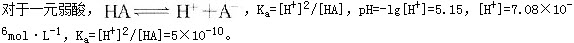
【单选题】

[9/72]下列化合物中,能发生银镜反应的是()
A.
甲酸
B.
乙酸
C.
乙酸甲酯
D.
乙酸乙酯
参考答案:
A
参考解析:
银镜反应是醛特有的反应,而甲酸具有醛基结构,故能发生银镜反应。
【单选题】

[10/72]将1mmolBaSO 4(分子量为233)溶于10L水中,在该温度下K sp(BaSO 4)=1.0×10 -10,问此时有多少克样品未溶解?()
A.
0.0021
B.
0.021
C.
0.21
D.
0.233
参考答案:
C
参考解析:
AB型难溶物溶解度S与溶度积Ksp关系,Ksp=S2,10L水中已经溶解的BaSO4的量为,未溶解的量为

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





