
创建自己的小题库
搜索

原子核外电子的排布题库
题数
707
考试分类
高中化学>原子核外电子的排布
售价
¥25
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-原子核外电子的排布
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【简答题】

[1/707]某元素的最高正化合价与最低负化合价的代数和为4,则该元素原子的最外层电子数为( ) A.4B.5C.6D.7
参考答案:
| 设某元素的最高正化合价为x,最低负价x-8, x+(x-8)=4, 解得x=+6, 最高正价数等于最外层电子数, 所以该元素原子的最外层电子数为6, 故选C. |
参考解析:
无
【简答题】

[2/707]A、B、C、D四种元素的原子序数依次增大,且均小于18.B、C元素原子的最外层电子数之和等于D元素原子的最外层电子数,A、C同主族且C元素原子的核外电...
参考答案:
| A、B、C、D四种元素的原子序数依次增大,且均小于18,A、C同主族且C元素原子的核外电子数是A元素原子核内质子数的两倍,则A为O,C为S;B、C元素原子的最外层电子数之和等于D元素原子的最外层电子数,C的最外层电子数为6,则B的最外层电子数为1,D的最外层电子数为7,则B为Na,D为Cl, A.电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为C>D>A>B,故A正确; B.非金属性越强,气态氢化物越稳定,则稳定性为A>D>C,故B错误; C.B分别与A、C、D可形成四种化合物氧化钠、过氧化钠、硫化钠、氯化钠四种化合物,故C正确; D.B分别与A、C、D形成的化合物中过氧化钠含有离子键和非极性共价键,故D错误; 故选BD. |
参考解析:
无
【简答题】

[3/707]A、B、C三种元素的原子具有相同的电子层数,且B的核外电子数比A多2个,C的质子数比B多4个,1molA的单质与酸反应,能置换出1gH2,这时,A转化...
参考答案:
| A、B、C三种元素的原子具有相同的电子层数,则A、B、C三种元素处于同一周期,1molA的单质与酸反应,能置换出1gH2,则A为金属,令A的化合价为x,根据电子转移守恒有x=1,A转化为具有氖原子相同的电子层结构的离子,故A为钠元素;B的核外电子数比A多2个,则B为铝元素;C的质子数比B多4个,则C为氯元素. 即A为钠元素;B为铝元素;C为氯元素. (1)由上述分析可知,A为Na,B为Al,C为Cl,答:A、B、C的元素符号分别为Na、Al、Cl; (2)A为钠元素,钠与水反应生成氢氧化钠与氢气,反应离子方程式为2Na+2H2O═2Na++2OH-+H2↑,答:2Na+2H2O═2Na++2OH-+H2↑; (3)A为钠元素,C为氯元素,钠在氯气中燃烧生成氯化钠,反应方程式为2Na+Cl2
|
参考解析:
无
【简答题】

[4/707]下列元素中,最高正化合价数值最大的是( ) A.NaB.ClC.SD.Si
参考答案:
| B |
参考解析:
无
【简答题】

[5/707]同一周期(短周期)各元素形成单质的沸点变化如下图所示(按原子序数连续递增顺序排列).该周期部分元素氟化物的熔点见下表. 氟化物 AF BF2 DF4 ...
参考答案:
| 图中曲线表示8种元素的原子序数(按递增顺序连续排列)和单质沸点的关系,H、I的沸点低于0℃,根据气体的沸点都低于0℃,可推断H、I为气体,气体元素单质为非气体,故为第三周期元素,则A为Na,B为Mg,C为Al,D为Si,E为P、G为S,H为Cl,I为Ar, (1)A为Na元素,原子核外电子数为11,故共有11种不同运动状态的电子,原子核外电子排布式为1s22s22p63s1,有4种不同能级的电子, 故答案为:11;4; (2)氢氧化铝为两性氢氧化物,电离方程式为:AlO2-+H++H2O⇌Al(OH)3⇌Al3++3OH-, 故答案为:AlO2-+H++H2O⇌Al(OH)3⇌Al3++3OH-; (3)NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,故MgF2的熔点比NaF高, 故答案为:NaF与 MgF2为离子晶体,SiF4为分子晶体,故SiF4的熔点低;Mg2+的半径比Na+的半径小,故MgF2的熔点比NaF高; (4)同周期自左而右非金属性增强,非金属性Cl>S>P,非金属性越强氢化物越稳定,故HCl最稳定性, Na+、Mg2+、Al3+电子层结构相同,电子层结构相同核电荷数越大离子半径越小,故离子半径Na+>Mg2+>Al3+, 故答案为:HCl;Na+>Mg2+>Al3+. |
参考解析:
无
【简答题】

[6/707]有A、B、C三种短周期元素,最外层电子数之和为17,质子数之和为31.若C为Ar,则关于A、B两种元素的说法错误的是( ) A.如果A是金属元素,则...
参考答案:
| AC |
参考解析:
无
【简答题】

[7/707]短周期元素W、X、Y和Z的原子序数依次增大.金属W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属...
参考答案:
| B |
参考解析:
无
【简答题】

[8/707]A、B、C、D、E代表5种元素.请填空:(1)A元素基态原子的最外层有3个未成对电子,次外层有2个电子,其元素符号为______(2)B元素的负一价离...
参考答案:
| (1)基态原子的最外层有3个未成对电子,次外层有2个电子的元素符号为N,其电子排布式为:1s22s22p3,故答案为:N; (2)设元素B的核电荷数是a,C元素原子的核电荷数为b,因为阴离子B-与阳离子C+电子层结构都与氩相同相同,即核外电子数相同,所以a=18-1=17,b=18+1=19,则B-为Cl-,其结构示意图为: 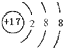 ,C为K原子, 其电子排布式:1s22s22p63s23p64s1,故答案为: 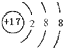 ;1s22s22p63s23p64s1. (3)元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则E为Cu, 其电子排布式为:1s22s22p63s23p63d104s1或[Ar]3d104s1, 故答案为:1s22s22p63s23p63d104s1或[Ar]3d104s1. |
参考解析:
无
【简答题】

[9/707]有aXn-和bYm+两种单原子离子,它们的电子层结构相同,下列关系式或化学式正确是( ) A.a-n=b+mB.X的氢化物化学式为HnX或XHnC....
参考答案:
| aXn-和bYm+两种单原子离子,它们的电子层结构相同,则有a+n=b-m,故A、C错误; Xn-离子带n个负电荷,说明得到n个电子达到稳定结构,则氢化物的化学式为HnX或XHn,故B正确; Ym+离子带m个正电荷,说明原子最外层有m个电子,形成的化合物中Y应为+m价,则氧化物的化学式为Y2Om或YO0.5m,故D错误, 故选B. |
参考解析:
无
【简答题】

[10/707]X、Y两种元素的原子,当它们分别获得1个电子后,都能形成稀有气体的电子层结构,X放出的能量大于Y,则下列推断中不正确的是 [ &...
参考答案:
| A |
参考解析:
无

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





