
创建自己的小题库
搜索

化学科学探究题库
题数
426
考试分类
高中化学>化学科学探究
售价
¥20
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-化学科学探究
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【简答题】

[1/426]易拉罐主要为铝合金,其中以铝铁合金和铝镁合金最为常见。现取几小块易拉罐碎片进行下列实验,其中实验方案与现象、结论正确的是 序号实验方案现象、结论A加入...
参考答案:
|
B
|
参考解析:
答案A加入盐酸,产生无色气体结论含铝、铁或铝、镁。加入NaOH 溶液只有铝反应产生无色气体,铁、镁不反应故正确。加入盐酸后,所得溶液中再加入少量NaOH溶液,也可能是沉淀A(OH)3, 加入KSCN 溶液,金属单质与之不反应,即便含铁元素溶液不会变色
【简答题】

[2/426]用 NH 4Cl进行如下实验,试判断发生的现象,并简单说明原因。 (1) 用玻璃棒蘸取少量 NH 4Cl溶液与pH试纸接触时,试纸显示的颜色与标准比色...
参考答案:
|
(1)< 酸 NH
4
++H
2O
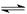 NH
3·H
2O+H
+ NH
3·H
2O+H
+
(1)H 2 (3)C |
参考解析:
(1)NH
4Cl是强酸弱碱盐,NH
4
+水解显酸性,方程式为NH
4
++H
2O
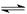 NH
3·H
2O+H
+。
NH
3·H
2O+H
+。
(2)氯化铵显酸性,所以能和镁反应产生氢气。
(3)氨水中存在电离平衡NH 3·H 2O NH
4
++OH
-。加入少量氯化铵固体,增大NH
4
+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
NH
4
++OH
-。加入少量氯化铵固体,增大NH
4
+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
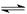 NH
3·H
2O+H
+。
NH
3·H
2O+H
+。
(2)氯化铵显酸性,所以能和镁反应产生氢气。
(3)氨水中存在电离平衡NH 3·H 2O
 NH
4
++OH
-。加入少量氯化铵固体,增大NH
4
+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
NH
4
++OH
-。加入少量氯化铵固体,增大NH
4
+浓度,抑制氨水的电离,所以碱性降低,pH减小,答案选C。
【简答题】

[3/426]某研究性学习小组探究金属锈蚀的条件,进行如下对照实验: 【图片】【实验现象】数天后铁钉锈蚀情况:A无锈蚀,B无锈蚀,C有锈蚀;【实验结论】金属锈蚀的条...
参考答案:
| 【实验结论】通过实验现象:A中铁钉与水接触但是与氧气隔绝不被腐蚀;B中铁钉与氧气接触但是与水隔绝不被腐蚀;C铁钉与氧气、水接触发生腐蚀,可知金属的腐蚀条件是在水和氧同时存在的环境,故答案为:水和氧同时存在的环境; 【结论分析】铁钉在潮湿的空气中容易发生的腐蚀是电化学腐蚀,电化学腐蚀又分为吸氧腐蚀和析氢腐蚀,在酸性介质中发生析氢腐蚀,在中性或弱碱性环境下发生吸氧腐蚀,铁钉在水中发生吸氧腐蚀,负极电极反应式为:Fe-2e-=Fe2+ 故答案为:电化学; Fe-2e-=Fe2+; 【拓展应用】金属防护的方法金属腐蚀的防护主要方法有:①改变金属的内部结构.例如,把铬、镍加入普通钢中制成不锈钢.②在金属表面覆盖保护层.例如,在金属表面涂漆、电镀或用化学方法形成致密耐腐蚀的氧化膜等.③电化学保护法:a.外加电流的阴极保护法、牺牲阳极的阴极保护法, 故答案为:外接电源的阴极保护法. |
参考解析:
无
【简答题】

[4/426](14分)三草酸合铁酸钾晶体K 3[Fe(C 2O 4) 3]·3H 2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得...
参考答案:
|
(1)I-A-J-I (3分)
(2)取固体加入少量的水溶液,再加入BaCl 2溶液;有白色沉淀加稀盐酸并将产生的气体通入澄清石灰水。(3分) (3)假设2成立(2分) 铁单质(2分) 溶液呈血红色,(2分) 假设(3)成立 (2分) |
参考解析:
略
【简答题】

[5/426]【图片】(1) 实验过程中,可能观察到的主要现象有: ① &nbs...
参考答案:
|
(1) ①铜片表面产生气泡,铜片变小并逐渐消失;②小烧杯中溶液的颜色逐渐变成绿色;③大烧杯中有红棕色气体生成,随后气体颜色又逐渐褪去;④大烧杯内液面上升,水槽中液面下降。(2) 反应体系封闭,无氮氧化物逸出,不污染环境。(3) 轻轻掀起倒扣的大烧杯,进入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体。
|
参考解析:
:本题以教材中铜与浓硝酸的反应设计成实验试题,装置简单但有一定的新意(学生的陌生度较大),考查了学生的观察能力和对实验的简单评价能力。(1) ①铜片表面产生气泡,铜片变小并逐渐消失;②小烧杯中溶液的颜色逐渐变成绿色;③大烧杯中有红棕色气体生成,随后气体颜色又逐渐褪去;④大烧杯内液面上升,水槽中液面下降。(2) 反应体系封闭,无氮氧化物逸出,不污染环境。(3) 轻轻掀起倒扣的大烧杯,进入适量的空气,若有红棕色气体生成,则证明最终气体生成物为NO气体。
【简答题】

[6/426]对照实验是研究物质性质的一种重要方法,下列不是用来做对照实验的是( ) A. 【图片】B. 【图片】C. 【图片】D. 【图片】
参考答案:
| D |
参考解析:
无
【简答题】

[7/426]下列关于对燃烧现象的认识中,不正确的是( ) A.燃烧一定是氧化还原反应 B.燃烧一定发光放热 C.燃烧一定是化学反应 D.燃烧一定有氧气参与
参考答案:
| D |
参考解析:
无
【简答题】

[8/426]每个梦想都值得灌溉,每个人骨子里都不缺少勇气,成功没有任何隐藏的奥秘,只有自己。谢谢《功夫熊猫》中的熊猫阿宝,让我们收获了梦想、勇气与责任。今天,让我...
参考答案:
| A |
参考解析:
无
【简答题】

[9/426](14分)下图是有关硫及其化合物的实验装置: 【图片】实验中用到的实验试剂在下列中选择:①浓硫酸;②70%硫酸;③25%硫酸;④新开封的亚硫酸钠粉末;...
参考答案:
|
(1)① (2) 2:1 (3)③⑤ FeS+ 2H + = H 2S↑+Fe 2+ (4)SO 2 + 2OH - = SO 3 2-+H 2O (5)吸收尾气 安全瓶作用 |
参考解析:
略
【简答题】

[10/426]某研究性学习小组用如图所示装置研究不同能量之间的转化问题。下列说法正确的是( ) 【图片】A.断开开关S1,按下开...
参考答案:
|
A
|
参考解析:
断开开关S
1,按下开关S
2,形成原电池:Fe+Cu
2
+=Fe
2
++Cu,有电流产生;
断开开关S 2,按下开关S 1,构成电解装置,电解转化为化学能
答案为A
断开开关S 2,按下开关S 1,构成电解装置,电解转化为化学能
答案为A

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





