
创建自己的小题库
搜索

氯气题库
题数
1909
考试分类
高中化学>氯气
售价
¥30
 手机预览
手机预览
收藏
分享
去刷题
简介
高中化学-氯气
...更多



0道

0道

0道



章节目录
题目预览(可预览10题)
【简答题】

[1/1909]制备金属氯化物,常用两种方法:①用金属与氯气直接化合得到;②用金属与盐酸反应制得。下列氯化物中既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得的...
参考答案:
|
C
|
参考解析:
无
【简答题】

[2/1909]探究氯气的性质时,将干燥的有色布条和湿润的有色布条分别放入两个集气瓶中,同时通入氯气后,可观察到的现象为______,该实验中起漂白作用的物质为___...
参考答案:
| 干燥的氯气不具有漂白性,不能使有色布条褪色,但氯气和水能反应生成盐酸和次氯酸,次氯酸有漂白性,可使有色布条褪色,氯气通入氢氧化钠溶液中生成氯化钠、次氯酸钠和水,反应的方程式为2NaOH+Cl2=NaClO+NaCl+H2O, 故答案为:潮湿有色布条褪色而干燥有色布条不褪色;HClO;2NaOH+Cl2=NaClO+NaCl+H2O. |
参考解析:
无
【简答题】

[3/1909](1)有一瓶被漂白过的品红试液,甲同学认为是被Cl2漂白,乙同学则认为是被SO2漂白了,请用简单的实验方法判断出到底哪位同学的猜测是真的______....
参考答案:
| (1)氯气和二氧化硫的漂白原理不同,前者不可逆,后者可逆,如加热漂白过的试液,如仍变红色,则乙同学对,否则,甲同学对, 故答案为:加热漂白过的试液,如仍变红色,则乙同学对,否则,甲同学对; (2)①CH3COONH4溶液呈中性,加入CH3COONH4,而其它三种溶液都呈碱性,不能判断甲乙两同学的解释是否正确, 故答案为:B; ②CH3COONH4溶液呈中性,加入CH3COONH4,如pH不变,说明是由于水解的原因,如pH变大,是由于醋酸根离子抑制了醋酸的电离,使[H+]减小, 故答案为:不变;增大. |
参考解析:
无
【简答题】

[4/1909]实验室制取气体的方案可行的是( ) A.浓硫酸、食盐、二氧化锰共热制取Cl2B.食盐、硝酸共热制取HClC.溴化钠与...
参考答案:
|
AD
|
参考解析:
因NaCl+H
2SO
4(浓)====HCl↑+NaHSO
4,故可用NaCl与浓H
2SO
4代替浓HCl制Cl
2;硝酸也为挥发性酸,不能用浓HNO
3制HCl。Br
-有较强还原性,而浓H
2SO
4有较强氧化性,浓H
2SO
4能将Br
-氧化成Br
2,故不能用浓H
2SO
4制HBr,而浓H
3PO
4为高沸点酸,无强氧化性,可用其制取HI。
【简答题】

[5/1909]下列叙述正确的是 [ ] A.草木灰和硫铵混合施用可使肥效更高 B.Mg(OH)2和Al(...
参考答案:
| B |
参考解析:
无
【简答题】

[6/1909]某化学实验的尾气中含有较多的氯气.要吸收这些尾气,下列试剂中最合适的是( ) A.烧碱溶液B.饱和石灰水C.自来水D.食盐水
参考答案:
| A、因氯气能与烧碱反应,且相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,则烧碱溶液的吸收效果好,故A正确; B、虽氯气能与饱和石灰水反应,但相同条件下,氢氧化钠的溶解度大于氢氧化钙的溶解度,其吸收效果不如烧碱溶液,故B错误; C、氯气微溶于水,吸收效果不好,故C错误; D、食盐水中氯离子浓度较大,抑制氯气的溶解,则吸收效果最不好,故D错误; 故选A. |
参考解析:
无
【简答题】

[7/1909](8分)Ⅰ 溴被称为海洋元素,向盐卤中通入氯气可制得溴:Cl 2 + 2NaBr =" 2NaCl" + Br 2,该反应被氧化的元素为 ...
参考答案:
|
(8分)Ⅰ Br(1分) ; 0.2N
A或1.204×10
23 (1分)
Ⅱ (1) Ca(ClO) 2+CO 2+H 2O=CaCO 3+2HClO 2HClO 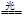 2HCl+O
2↑ (每空1分) 2HCl+O
2↑ (每空1分)
(2)4Fe 2 ++ 4H + +O 2=4Fe 3 ++ 2H 2O (2分) ;2Fe 3 ++2I - = 2Fe 2 + + I 2 (2分) |
参考解析:
略
【简答题】

[8/1909]下列叙述正确的是( )①73Li+中含有的中子数与电子数之比为2:1②在C2H6分子中极性共价键与非极性共价键数之比为3:1③常温下,11.2L的甲...
参考答案:
| ①73Li+中含有的中子数为4与电子数为2,中子数与电子数之比为2:1,故①正确; ②在C2H6分子中极性共价键有6个,非极性共价键有1个,两者数目之比为6:1,故②错误; ③甲烷(CH4)气体中含有的氢、碳原子数之比为4:1,故③正确; ④5.6g铁与足量的氯气反应失去的电子与参与反应的铁的物质的量之比为3:1.故④错误; 故选C. |
参考解析:
无
【简答题】

[9/1909]下列气体,溶于水后可以生成两种酸的是( ) A.SO2B.CO2C.Cl2D.NH3
参考答案:
| A.SO2与水反应生成亚硫酸,生成一种酸,故A错误; B.CO2与水反应生成碳酸,生成一种酸,故B错误; C.Cl2与水反应生成盐酸和次氯酸,生成两种酸,故C正确; D.NH3与水反应生成一水合氨,生成一种碱,故D错误; 故选C. |
参考解析:
无
【简答题】

[10/1909](8分)用如图所示装置进行下列实验。 【图片】(1)在检查装置气密性后,向试管a中加入10 mL 6 mol·L -1稀硝酸和1 g铜片,立即将带有导...
参考答案:
|
(1)3Cu+8HNO
3====3Cu(NO
3)
2+2NO↑+4H
2O 2NO+O
2====2NO
2
(2)铜与硝酸反应为放热反应,随着反应的进行,放出的热量使溶液的温度升高,反应加快 (3)先向试管a中加入10 mL 6 mol·L -1稀硝酸,然后将试管倾斜,将铜片放在试管内壁上方不致滑下,塞上插有导管的塞子,再将试管慢慢直立 (4)将反应物稍微加热、加入相对较浓的硝酸、用铜粉代替铜片等(任写2种,其他合理答案同样给分) |
参考解析:
无

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





