创建自己的小题库
搜索
【简答题】


甲醇是一种优质燃料,可制作燃料电池。 (1)工业上可用下列两种反应制备甲醇: CO(g) + 2H 2(g)
 CH 3OH(g) Δ H 1 CO 2(g) + 3H 2(g)
CH 3OH(g) Δ H 1 CO 2(g) + 3H 2(g)
 CH 3OH(g) + H 2O(g) Δ H 2 已知:2H 2(g)+ O 2(g) = 2H 2O(g) Δ H 3。则2CO(g)+O 2(g) = 2CO 2(g) 的反应热 Δ H=_____________(用Δ H 1、Δ H 2、Δ H 3表示)。 (2)生产甲醇的原料CO和H 2来源于:CH 4(g) + H 2O(g)
CH 3OH(g) + H 2O(g) Δ H 2 已知:2H 2(g)+ O 2(g) = 2H 2O(g) Δ H 3。则2CO(g)+O 2(g) = 2CO 2(g) 的反应热 Δ H=_____________(用Δ H 1、Δ H 2、Δ H 3表示)。 (2)生产甲醇的原料CO和H 2来源于:CH 4(g) + H 2O(g)
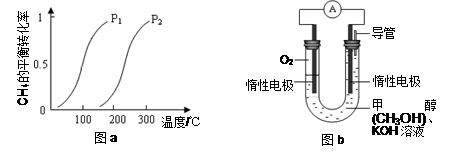
 CO(g) + 3H 2(g) Δ H 4。 一定条件下CH 4的平衡转化率与温度、压强的关系如图a。则Δ H 4______0,P 1_________P 2 (填“<”、“>”或“=”) (3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_____ __ ______。
CO(g) + 3H 2(g) Δ H 4。 一定条件下CH 4的平衡转化率与温度、压强的关系如图a。则Δ H 4______0,P 1_________P 2 (填“<”、“>”或“=”) (3)某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、减小、不变)。负极的电极反应式为_____ __ ______。
 (4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ; 阳极泥为:
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ; 阳极泥为:

 分享
分享
 反馈
反馈 收藏
收藏 举报
举报参考答案:

举一反三
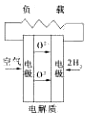
【简答题】有下列4种燃料电池的工作原理示意图,其中正极反应的产物为水的是( )
A.
 固化氧化物燃料电池
固化氧化物燃料电池
 固化氧化物燃料电池
固化氧化物燃料电池B.
 碱性氢氧化物电池
碱性氢氧化物电池
 碱性氢氧化物电池
碱性氢氧化物电池C.
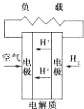 质子交换膜燃料电池
质子交换膜燃料电池
 质子交换膜燃料电池
质子交换膜燃料电池D.
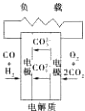 熔融盐燃料电池
熔融盐燃料电池
 熔融盐燃料电池
熔融盐燃料电池【单选题】2019年3月19日,我国首架商飞新能源验证机()在郑州上街机场试飞成功。试飞过程中,飞机飞行平稳,全系统状态良好,符合仿真预期,作为动力源的氢燃料电池动力系统得到充分验证。
A.
“奖状680”
B.
“灵雀H”
C.
“新舟700”
D.
“飞鸿98”

相关题目:
【简答题】有下列4种燃料电池的工作原理示意图,其中正极反应的产物为水的是( )
A.
 固化氧化物燃料电池
固化氧化物燃料电池
 固化氧化物燃料电池
固化氧化物燃料电池B.
 碱性氢氧化物电池
碱性氢氧化物电池
 碱性氢氧化物电池
碱性氢氧化物电池C.
 质子交换膜燃料电池
质子交换膜燃料电池
 质子交换膜燃料电池
质子交换膜燃料电池D.
 熔融盐燃料电池
熔融盐燃料电池
 熔融盐燃料电池
熔融盐燃料电池【单选题】2019年3月19日,我国首架商飞新能源验证机()在郑州上街机场试飞成功。试飞过程中,飞机飞行平稳,全系统状态良好,符合仿真预期,作为动力源的氢燃料电池动力系统得到充分验证。
A.
“奖状680”
B.
“灵雀H”
C.
“新舟700”
D.
“飞鸿98”

参考解析:


AI解析
重新生成

题目纠错 0
发布

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫