
创建自己的小题库
搜索
【简答题】


某化学兴趣小组对课本介绍的三种金属Mg、Ti(钛)、Cu的金属活动顺序进行探究.
提出假设:a、Ti金属活动性比镁强 b、Mg金属活动性比Cu强
查阅资料:在相同条件下,金属与酸反应,产生气泡的速度越快,则该金属活动性越强.
实验设计:同温下,取大小相同的三种金属薄片,分别投入等体积等浓度的足量的稀盐酸中反应,观察现象.请回答:
(1)三种金属加入盐酸前都先用砂布将表面擦光亮,其目的是______
A.除去氧化膜,利于直接反应
B.使表面不平整,易反应
C.使表面光亮,易观察现象
D.使反应温度相同,易反应
(2)填写下表中的有关现象和结论:
TiMgCu与盐酸反应现象放出气泡速度缓慢放出气泡速度快______
结论原假设中______不正确(填“a”、“b”、“ab”)理由是______
______;三种金属的活动性顺序为______>______>______.

 分享
分享
 反馈
反馈 收藏
收藏 举报
举报参考答案:

举一反三
【单选题】把金属镍(Ni)、锰(Mn)分别放入盐溶液中,反应的结果如下表所示:盐溶液金属MgC12溶液Ni的盐溶液CuSO4溶液Ni无金属析出-有金属析出Mn无金属析出有金属析出有金属析出则它们的金属活动性由强到弱的顺序为( )
A.
MgNiMnCu
B.
CuNiMnMg
C.
CuMnNiMg
D.
MgMnNiCu
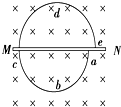
【简答题】在匀强磁场中置一均匀金属薄片,有一个带电粒子在该磁场中按如图所示轨迹运动.由于粒子穿过金属片时有动能损失,在MN上、下方的轨道半径之比为10:9,不计粒子的重力及空气的阻力,下列判断中正确的是( )
A.
粒子带正电
B.
粒子沿abcde方向运动
C.
粒子通过上方圆弧比通过下方圆弧时间长
D.
粒子恰能穿过金属片10次

【简答题】将X、Y、Z三块大小相同的金属片分别投入到稀盐酸中,X表面无明显现象,Y表面缓慢地产生气泡,Z表面迅速产生大量气泡。则X、Y、Z的金属活动性顺序为
A.
X>Z>Y
B.
Z>Y>X
C.
X>Y>Z
D.
Z>X>Y
【单选题】有A、B、C三种金属,把A、C分别放入稀硫酸中,C有反应,A无反应;A能从B的化合物溶液中置换出B.这三种金属活动性由强到弱的顺序是( )
A.
.C>A>B
B.
.A>B>C
【单选题】把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.。若a、b相连时,a为负极;c、d相连时c为负极;a、c相连时c为正极;b、d相连时b为正极。.则这四种金属活动性顺序(由大到小)为()
A.
a>b>c>d
B.
a>c>d>b
C.
c>a>b>d
D.
b>d>c>a

相关题目:
【单选题】把金属镍(Ni)、锰(Mn)分别放入盐溶液中,反应的结果如下表所示:盐溶液金属MgC12溶液Ni的盐溶液CuSO4溶液Ni无金属析出-有金属析出Mn无金属析出有金属析出有金属析出则它们的金属活动性由强到弱的顺序为( )
A.
MgNiMnCu
B.
CuNiMnMg
C.
CuMnNiMg
D.
MgMnNiCu
【简答题】在匀强磁场中置一均匀金属薄片,有一个带电粒子在该磁场中按如图所示轨迹运动.由于粒子穿过金属片时有动能损失,在MN上、下方的轨道半径之比为10:9,不计粒子的重力及空气的阻力,下列判断中正确的是( )
A.
粒子带正电
B.
粒子沿abcde方向运动
C.
粒子通过上方圆弧比通过下方圆弧时间长
D.
粒子恰能穿过金属片10次


【简答题】将X、Y、Z三块大小相同的金属片分别投入到稀盐酸中,X表面无明显现象,Y表面缓慢地产生气泡,Z表面迅速产生大量气泡。则X、Y、Z的金属活动性顺序为
A.
X>Z>Y
B.
Z>Y>X
C.
X>Y>Z
D.
Z>X>Y
【单选题】有A、B、C三种金属,把A、C分别放入稀硫酸中,C有反应,A无反应;A能从B的化合物溶液中置换出B.这三种金属活动性由强到弱的顺序是( )
A.
.C>A>B
B.
.A>B>C
【单选题】把a、b、c、d四块金属片浸泡在稀硫酸中,用导线两两相连可以组成各种原电池.。若a、b相连时,a为负极;c、d相连时c为负极;a、c相连时c为正极;b、d相连时b为正极。.则这四种金属活动性顺序(由大到小)为()
A.
a>b>c>d
B.
a>c>d>b
C.
c>a>b>d
D.
b>d>c>a

参考解析:


AI解析
重新生成

题目纠错 0
发布

 复制链接
复制链接 新浪微博
新浪微博 分享QQ
分享QQ 微信扫一扫
微信扫一扫





